推荐产品
公司新闻/正文
利用重组鲎试剂进行内毒素检测
人阅读 发布时间:2022-07-13 10:15
利用重组鲎试剂进行内毒素检测

富士胶片株式会社 生命科学&工程研究所
福地 大树
◆前言
内毒素是存在于革兰氏阴性菌细胞壁外膜的脂多糖(Lipopolysaccharide),进入血液后,只需极少量即可引发出发热症状,大量存在则表现出强毒性,可导致内毒素休克甚至死亡 1)。由于革兰氏阴性菌广泛分布于环境中,存在混入生产过程的风险,而混入的内毒素具有耐热性,不易灭活,因此要求注射剂和医疗器械接受严密的内毒素污染管理。近年备受关注的再生医疗、疫苗、抗体和核酸医药相关的产品,内毒素管理对这类产品而言非常重要。
目前检测主流是使用一种利用了马蹄蟹血细胞提取物成分凝血系统的试剂——鲎试剂,来检测内毒素,但为了保护鲎科、稳定供应鲎试剂、减少产品批间差异、提高检测稳定性,各鲎试剂厂家开始促进使用人工原料生产的重组蛋白来研发内毒素检测试剂。
◆内毒素检查法的检测原理
内毒素检查法是使用从马蹄蟹血细胞成分制备得到的裂解试剂进行内毒素检测或定量的方法。马蹄蟹的血细胞提取物成分具有使内毒素凝固的反应体系,这种凝固反应以多个丝氨酸蛋白酶前体依次活化的级联反应为基础(图 1)。
内毒素激活马蹄蟹血细胞提取物中含有的 C 因子,随后活化 C 因子激活 B 因子。活化 B 因子再激活凝血酶原,激活的凝血酶将凝血蛋白原底物水解,并将其转化为凝固蛋白,生成不溶性凝胶。
另外,在马蹄蟹血细胞提取物中,级联反应还会以 G 因子为起点,与 β-葡聚糖发生反应,由 β-葡聚糖引起凝血反应(图 1)。若想要特异性检测内毒素,需要通过去除 G 因子或抑制以 G 因子为起点的级联反应来检测。
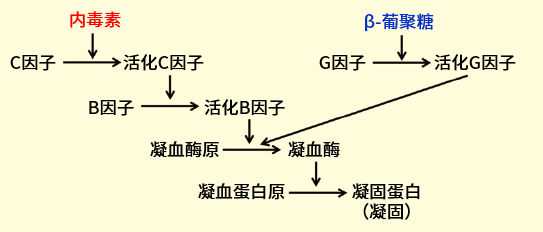
图 1. 由内毒素、β-葡聚糖引起的凝血级联反应
◆内毒素的检测方法
内毒素检测大致可分为以下 3 种:凝胶法(以裂解物试剂的凝胶形成作为指标)、浊度法(检测伴随凝胶化变化的吸光度或透射率来测定浊度变化)、显色法(以合成底物水解产生的显色作为指标)。显色法比凝胶法、浊度法的灵敏度要高。利用重组蛋白的内毒素检测试剂中,除了使用显色合成底物的显色法之外,还有荧光合成底物的检测方法。
◆利用重组蛋白的内毒素检测试剂
目前各公司销售的重组蛋白内毒素检测试剂可分为两种,使用 C 因子重组蛋白的单因子鲎试剂和使用 C 因子、B 因子、凝血酶原重组蛋白的三因子鲎试剂(图 2)。
单因子试剂由于级联反应没有放大,产生的蛋白酶活性小,需要使用荧光底物进行荧光检测。三因子体系试剂与单因子体系试剂相比,酶活性较大,可产生显色反应,因此可以用普通的酶标仪来检测。
另外,近年有报告称,B 因子对内毒素的特异性具有重要作用 2,3),相比只含有 C 因子的单因子鲎试剂,含 C 因子、B 因子和凝血酶原三因子鲎试剂更接近于天然鲎试剂。富士胶片和光一直致力于研发三因子重组鲎试剂,目前新推出的使用重组蛋白的重组鲎试剂(PYROSTAR™ Neo),有着良好的检测性能。
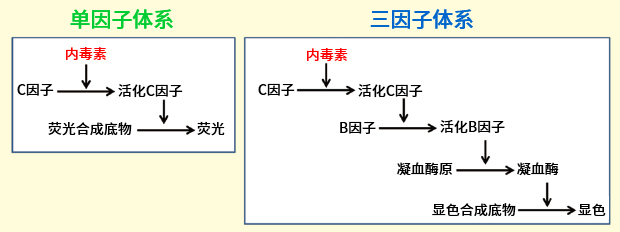
图 2. 利用重组蛋白的内毒素检测试剂种类
◆PYROSTAR™ Neo
本次富士胶片和光发售的重组鲎试剂 PYROSTAR™ Neo,具有以下的特点:对空白值进行了控制,空白值更低,因此可检测到更低的内毒素浓度(表 1)。另外,使用显色法进行检测是裂解试剂的常规分析方法之一,重组鲎试剂 PYROSTAR™ Neo 检测和分析时可使用能够进行动力学测定的恒温酶标仪和软件进行读数。PYROSTAR™ Neo 可以定量 0.001 EU/mL~50 EU/mL 范围内的内毒素浓度,并能够获得线性良好的标准曲线(相关系数在 0.980 以上)。
表 1. PYROSTAR™ Neo 与其他公司产品的比较
| PYROSTAR™ Neo |
其他公司产品 1 |
其他公司产品 2 |
其他公司产品 3 |
|
| 因子 |
三因子系统 |
单因子系统 |
||
| 定量范围 (EU/mL) |
0.001~50 |
0.005~50 |
0.005~5 |
0.005~50 |
| 检测方法 |
显色法 |
显色法 |
荧光法 |
荧光法 |
◆结语
目前内毒素检测试剂多为以鲎血为原料的裂解液鲎试剂,而使用人工重组蛋白的内毒素检测试剂,其历史较短,并未得到广泛应用。
在此背景下,为推进重组鲎试剂的应用,2021 年欧洲药典收录了采用荧光法的重组 C 因子鲎试剂并作为常规检测方法。在日本药典第十八次修订的新版本中,收录了《内毒素检测方法与使用重组鲎试剂的替代法》(「エンドトキシン試験法と測定試薬に遺伝子組換えタンパク質を用いる代替法」)作为补充参考信息,但重组鲎试剂并不属于内毒素检查法中规定的「马蹄蟹血细胞提取物成分制备的裂解试剂」。同样,美国药典也将重组鲎试剂视为替代法。据报告,使用替代法时,相比使用裂解试剂的内毒素检查法,需要对这两种方法进行对比研究,确保重组鲎试剂有相同或更高水平的真实性、准确度、灵敏度、特异性等 4)。
今后富士胶片和光将会继续推进重组鲎试剂应用于内毒素检测中的研究,但需满足真实性、准确度、灵敏度、特异性这几点才能满足考虑替代法的制药公司等用户的需求。我们将继续推进鲎试剂的研究,努力实现用户需求、环境和马蹄蟹保护之间的平衡。
◆参考文献
1)棚元憲一:エンドトキシンと医薬品の品質管理,国立医薬品食品衛生研究所報告,126,19(2008).
2)Kobayashi, Y. et al. : J. Biol. Chem., 290, 19379 (2015).
3)Tsuchiya, M. : Int. J. Dev. Res., 10, 36751 (2020).
4)菊池裕 他:医薬品医療機器レギュラトリーサイエンス,48,252(2017).
◆相关产品